Mikroskopické změny kyselosti v našich buňkách mohou mít dramatický dopad na jejich chování. K tomuto účinku dochází v důsledku koncentrace protonů neboli pH, což je míra kyselosti nebo zásaditosti roztoku. Na tyto výkyvy jsou obzvláště citlivé bílkoviny, které jsou hlavními tahouny našich buněk. Změna reakce proteinů na pH může přispět k rozvoji onemocnění, jako je rakovina a neurodegenerativní poruchy, jako je Alzheimerova choroba a Huntingtonova choroba.
Po celá léta se výzkumníci snažili přesně určit jak proteiny reagují na měnící se hladiny pH. Tradičně byla identifikace proteinů citlivých na pH pracný proces, který vyžadoval pečlivé testování každého proteinu jednotlivě v rámci signální dráhy, aby se zjistilo, zda reaguje na změny pH. Tento pečlivý přístup přinesl omezené výsledky. Ačkoli je známo, že pH hraje roli v důležitých buněčných procesech, jako je pohyb a dělení buněk, bylo potvrzeno, že pouze asi 70 cytoplazmatických proteinů z obrovského počtu je citlivých na pH.
Nyní vědci z University of Notre Dame vyvinuli revoluční počítačový nástroj, který tento proces výrazně urychluje. Tento program dokáže analyzovat stovky proteinů během několika dní a efektivně předvídat, které z nich jsou citlivé na změny pH a potenciálně přispívají k progresi onemocnění.
Rozluštění molekulárního kódu citlivosti na pH
Nová metoda staví na existujících proteinových strukturních datech uložených v globálním úložišti zvaném RCSB Protein Data Bank. Program pak používá experimentální data známá jako hodnoty pKa, které udávají pH, při kterém specifické aminokyseliny (budoucí proteinové prvky) získávají nebo ztrácejí protony. Tyto informace umožňují programu modelovat změny elektrických nábojů v proteinech v závislosti na úrovních pH a předpovídat, jak tyto změny náboje mohou změnit strukturu proteinu.
Výzkumníci se zaměřili na aminokyseliny, které snadno mění náboj v úzkém rozmezí pH nalezeném ve zdravých buňkách (kolem 7,2–7,6). I malé posuny v těchto důležitých aminokyselinových nábojích mohou způsobit kaskádový efekt, který se šíří po celé struktuře proteinu a ovlivňuje jeho funkci. Tento jev se nazývá alosterie, nepřímý regulační mechanismus, který ovlivňuje aktivitu proteinů mimo místa, kde dochází ke změnám pH.
Cílená léčba rakoviny pomocí počítačového objevu
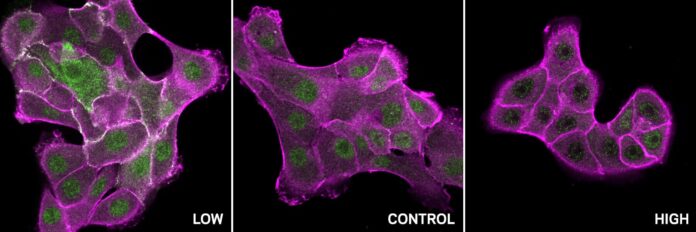
Program úspěšně předpověděl pH citlivost klíčového proteinu zvaného SHP2, který se podílí na signalizaci, imunitní odpovědi a vývoji. Experimenty potvrdily, že připojení protonů ke dvěma specifickým zbytkům v SHP2 způsobí radikální změnu jeho tvaru, přepnutím z neaktivního „zavřeného“ stavu do aktivního „otevřeného“ stavu. Tento objev vrhá světlo na to, jak pH nenápadně kontroluje aktivitu SHP2.
Kromě toho program identifikoval vzor oblastí citlivých na pH v široké škále proteinů domény SH2, včetně c-Src. C-Src je často hyperaktivní u mnoha rakovin, což vede k nekontrolovanému růstu buněk. Analýza ukázala, že normální c-Src se chová odlišně při různých úrovních pH: je aktivní při nízkém pH a neaktivní při vysokém pH. Mutace spojené s rakovinou v těchto specifických oblastech citlivých na pH však tuto jemnou regulaci narušují, čímž se c-Src stává necitlivým na změny pH a podporuje jeho nadměrné namáhání v nádorech.
Tento objev otevírá nové možnosti pro cílenou léčbu rakoviny. Tím, že přesně pochopíme, jak pH reguluje aktivitu c-Src, mohou nyní výzkumníci vyvinout léky, které napodobují přirozené regulační mechanismy, obnovují normální citlivost na pH a selektivně inhibují mutantní, patogenní formu proteinu.
Tento revoluční počítačový nástroj slibuje revoluci v našem chápání funkce bílkovin ve zdraví a nemoci. Kromě rakoviny mají cílené terapie pro proteiny citlivé na pH obrovský potenciál pro léčbu řady onemocnění, u kterých nerovnováha pH vede k dysfunkci – od cukrovky a autoimunitních poruch až po traumatické poranění mozku. Jak výzkumníci využívají tuto novou sílu, budoucnost se stává jasnější pro vývoj vysoce cílených a účinných terapií.