Winzige Veränderungen im Säuregehalt unserer Zellen können enorme Auswirkungen auf deren Verhalten haben. Dieser Einfluss entsteht durch die sogenannte Protonenkonzentration oder den pH-Wert – ein Maß dafür, wie sauer oder alkalisch eine Lösung ist. Proteine, die Arbeitspferde unserer Zellen, reagieren besonders empfindlich auf diese Veränderungen. Veränderungen der pH-Reaktionsfähigkeit können zur Entstehung von Krankheiten wie Krebs und neurodegenerativen Erkrankungen wie Alzheimer und Huntington beitragen.
Seit Jahren kämpfen Forscher darum, genau zu bestimmen, wie Proteine auf sich ändernde pH-Werte reagieren. Traditionell war die Identifizierung pH-empfindlicher Proteine ein langwieriger Prozess: Jedes Protein innerhalb eines Signalwegs wurde akribisch getestet, um festzustellen, ob es auf pH-Änderungen reagierte. Dieser sorgfältige Ansatz hat nur begrenzte Ergebnisse erbracht. Während Wissenschaftler wissen, dass der pH-Wert bei entscheidenden zellulären Prozessen wie Zellbewegung und -teilung eine Rolle spielt, wurden von unzähligen Möglichkeiten nur etwa 70 zytoplasmatische Proteine als pH-empfindlich bestätigt.
Jetzt haben Forscher der University of Notre Dame ein bahnbrechendes Rechentool entwickelt, das diesen Prozess erheblich beschleunigt. Diese Pipeline kann Hunderte von Proteinen in nur wenigen Tagen analysieren und effizient vorhersagen, welche davon empfindlich auf pH-Änderungen reagieren und möglicherweise das Fortschreiten der Krankheit vorantreiben.
Den molekularen Code der pH-Empfindlichkeit entschlüsseln
Die neue Methode basiert auf vorhandenen Strukturdaten von Proteinen, die in einem globalen Repository namens RCSB Protein Data Bank gespeichert sind. Das Programm integriert dann experimentelle Daten, sogenannte pKa-Werte, die den pH-Wert angeben, bei dem bestimmte Aminosäuren (die Bausteine von Proteinen) Protonen gewinnen oder verlieren. Mithilfe dieser Informationen kann das Programm modellieren, wie sich elektrische Ladungen innerhalb von Proteinen in Abhängigkeit vom pH-Wert verschieben, und vorhersagen, wie diese Ladungsänderungen die Proteinstruktur verändern könnten.
Die Forscher konzentrierten ihre Aufmerksamkeit auf Aminosäuren, die ihre Ladung innerhalb des engen pH-Bereichs, der für gesunde Zellen typisch ist (etwa 7,2 bis 7,6), leicht umkehren. Selbst subtile Verschiebungen dieser entscheidenden Aminosäureladungen können einen Dominoeffekt auslösen, der sich auf die gesamte Proteinstruktur auswirkt und deren Funktion beeinträchtigt. Dieses Phänomen ist als Allosterie bekannt – ein indirekter Regulierungsmechanismus, der die Proteinaktivität weit entfernt von der Stelle beeinflusst, an der pH-Änderungen auftreten.
Krebsbekämpfung durch rechnergestützte Entdeckung
Die Pipeline hat erfolgreich die pH-Empfindlichkeit eines Schlüsselproteins namens SHP2 vorhergesagt, das an der Zellsignalisierung, Immunantwort und Entwicklung beteiligt ist. Experimente bestätigten, dass die Bindung von Protonen an zwei spezifische Reste innerhalb von SHP2 dazu führt, dass sich seine Form dramatisch ändert und es von einem inaktiven „geschlossenen“ Zustand in einen aktiven „offenen“ Zustand wechselt. Diese Entdeckung gibt Aufschluss darüber, wie der pH-Wert die SHP2-Aktivität subtil steuert.
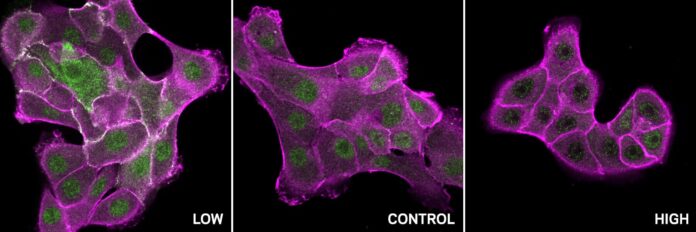
Darüber hinaus identifizierte die Pipeline ein Muster pH-empfindlicher Stellen in einer Vielzahl von SH2-Domänen enthaltenden Proteinen, einschließlich c-Src. C-Src ist bei vielen Krebsarten oft überaktiv und führt zu unkontrolliertem Zellwachstum. Die Analyse ergab, dass sich normales c-Src bei unterschiedlichen pH-Werten unterschiedlich verhält: Es ist bei niedrigem pH-Wert aktiv und bei hohem pH-Wert inaktiv. Allerdings stören krebsbedingte Mutationen an diesen spezifischen pH-empfindlichen Stellen diese empfindliche Regulierung, wodurch c-Src unempfindlich gegenüber pH-Änderungen wird und zu seiner Überaktivität in Tumoren beiträgt.
Diese Entdeckung eröffnet spannende Möglichkeiten für gezielte Krebstherapien. Durch das genaue Verständnis, wie der pH-Wert die c-Src-Aktivität reguliert, können Forscher nun Medikamente entwickeln, die die natürlichen Regulierungsmechanismen nachahmen, die normale pH-Empfindlichkeit wiederherstellen und die mutierte, krankheitsauslösende Form des Proteins selektiv hemmen.
Dieses bahnbrechende Rechenwerkzeug verspricht, unser Verständnis der Proteinfunktion bei Gesundheit und Krankheit zu revolutionieren. Über Krebs hinaus birgt die gezielte Behandlung von pH-empfindlichen Proteinen ein enormes Potenzial für die Behandlung einer Vielzahl von Erkrankungen, bei denen pH-Ungleichgewichte zu Funktionsstörungen beitragen – von Diabetes und Autoimmunerkrankungen bis hin zu traumatischen Hirnverletzungen. Wenn Forscher diese neue Kraft nutzen, sieht die Zukunft für die Entwicklung äußerst gezielter und wirksamer Therapien rosiger aus.