Pequeños cambios en la acidez dentro de nuestras células pueden tener enormes impactos en su comportamiento. Esta influencia proviene de algo llamado concentración de protones o pH, una medida de cuán ácida o alcalina es una solución. Las proteínas, los caballos de batalla de nuestras células, son particularmente sensibles a estos cambios. Las alteraciones en la capacidad de respuesta del pH pueden contribuir al desarrollo de enfermedades como el cáncer y trastornos neurodegenerativos como el Alzheimer y el Huntington.
Durante años, los investigadores han luchado por determinar exactamente cómo las proteínas responden a los cambios en los niveles de pH. Tradicionalmente, identificar proteínas sensibles al pH implicaba un proceso tedioso: probar meticulosamente cada proteína individualmente dentro de una vía de señalización para ver si reaccionaba a los cambios de pH. Este minucioso enfoque ha dado resultados limitados. Si bien los científicos saben que el pH desempeña un papel en procesos celulares cruciales como el movimiento y la división celular, solo se ha confirmado que unas 70 proteínas citoplasmáticas son sensibles al pH entre innumerables posibilidades.
Ahora, investigadores de la Universidad de Notre Dame han desarrollado una herramienta computacional innovadora que acelera drásticamente este proceso. Esta tubería puede analizar cientos de proteínas en tan solo unos días, prediciendo de manera eficiente cuáles son sensibles a los cambios de pH y potencialmente impulsando la progresión de la enfermedad.
Desentrañando el código molecular de la sensibilidad al pH
El nuevo método se basa en datos estructurales existentes de proteínas alojadas en un depósito global llamado RCSB Protein Data Bank. Luego, el programa incorpora datos experimentales conocidos como valores de pKa, que indican el pH al que aminoácidos específicos (los componentes básicos de las proteínas) ganan o pierden protones. Esta información permite al programa modelar cómo cambian las cargas eléctricas dentro de las proteínas dependiendo de los niveles de pH y predice cómo estos cambios de carga podrían alterar la estructura de las proteínas.
Los investigadores centraron su atención en los aminoácidos que cambian fácilmente su carga dentro del estrecho rango de pH típico de las células sanas (alrededor de 7,2 a 7,6). Incluso los cambios sutiles en estas cargas de aminoácidos cruciales pueden desencadenar un efecto dominó, que se extiende en cascada por toda la estructura de la proteína y afecta su función. Este fenómeno se conoce como alosterio, un mecanismo regulador indirecto que influye en la actividad de las proteínas lejos del sitio donde se producen los cambios de pH.
Apuntando al cáncer mediante descubrimiento computacional
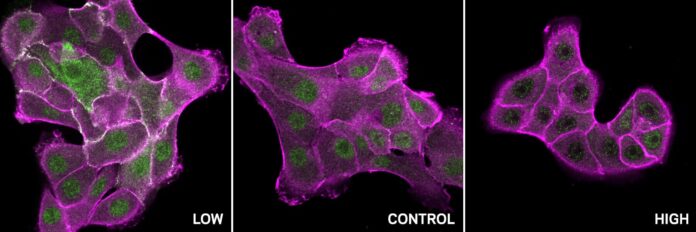
El proyecto predijo con éxito la sensibilidad al pH de una proteína clave llamada SHP2 implicada en la señalización celular, la respuesta inmunitaria y el desarrollo. Los experimentos confirmaron que la unión de protones a dos residuos específicos dentro de SHP2 hace que su forma cambie dramáticamente, pasando de un estado “cerrado” inactivo a un estado “abierto” activo. Este descubrimiento arroja luz sobre cómo el pH controla sutilmente la actividad de SHP2.
Además, el proyecto identificó un patrón de sitios sensibles al pH en una amplia gama de proteínas que contienen el dominio SH2, incluida c-Src. C-Src suele ser hiperactivo en muchos cánceres, lo que impulsa un crecimiento celular descontrolado. El análisis reveló que el c-Src normal se comporta de manera diferente en diferentes niveles de pH: es activo a pH bajo e inactivo a pH alto. Sin embargo, las mutaciones relacionadas con el cáncer en estos sitios específicos sensibles al pH alteran esta delicada regulación, lo que hace que c-Src sea insensible a los cambios de pH y contribuye a su hiperactividad en los tumores.
Este descubrimiento abre vías interesantes para las terapias dirigidas contra el cáncer. Al comprender con precisión cómo el pH regula la actividad de c-Src, los investigadores ahora pueden diseñar medicamentos que imiten los mecanismos reguladores naturales, restaurando la sensibilidad normal al pH e inhibiendo selectivamente la forma mutada de la proteína que provoca enfermedades.
Esta innovadora herramienta computacional promete revolucionar nuestra comprensión de la función de las proteínas en la salud y la enfermedad. Más allá del cáncer, apuntar a las proteínas sensibles al pH tiene un inmenso potencial para tratar una amplia gama de afecciones en las que los desequilibrios del pH contribuyen a la disfunción, desde diabetes y trastornos autoinmunes hasta lesiones cerebrales traumáticas. A medida que los investigadores aprovechan este nuevo poder, el futuro parece más brillante para el desarrollo de terapias altamente dirigidas y efectivas.