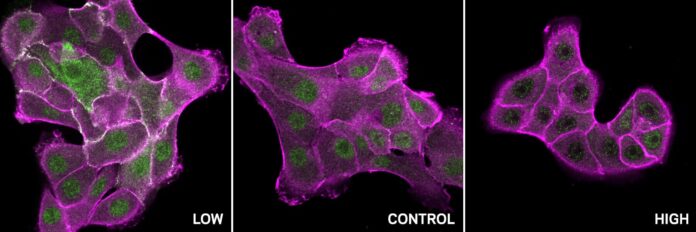
De minuscules changements d’acidité au sein de nos cellules peuvent avoir d’énormes impacts sur leur comportement. Cette influence provient de ce qu’on appelle la concentration de protons, ou pH – une mesure du degré d’acidité ou d’alcalinité d’une solution. Les protéines, bêtes de somme de nos cellules, sont particulièrement sensibles à ces changements. Les modifications de la réactivité du pH peuvent contribuer au développement de maladies comme le cancer et de troubles neurodégénératifs comme la maladie d’Alzheimer et la maladie de Huntington.
Pendant des années, les chercheurs ont eu du mal à déterminer exactement comment les protéines réagissent aux changements de pH. Traditionnellement, l’identification des protéines sensibles au pH impliquait un processus fastidieux : tester méticuleusement chaque protéine individuellement au sein d’une voie de signalisation pour voir si elle réagissait aux changements de pH. Cette approche minutieuse a donné des résultats limités. Alors que les scientifiques savent que le pH joue un rôle dans des processus cellulaires cruciaux tels que le mouvement et la division cellulaire, seules environ 70 protéines cytoplasmiques ont été confirmées comme sensibles au pH parmi d’innombrables possibilités.
Aujourd’hui, des chercheurs de l’Université de Notre Dame ont développé un outil informatique révolutionnaire qui accélère considérablement ce processus. Ce pipeline peut analyser des centaines de protéines en quelques jours seulement, prédisant efficacement celles qui sont sensibles aux changements de pH et susceptibles de favoriser la progression de la maladie.
Démêler le code moléculaire de la sensibilité au pH
La nouvelle méthode s’appuie sur les données structurelles existantes des protéines hébergées dans un référentiel mondial appelé RCSB Protein Data Bank. Le programme intègre ensuite des données expérimentales appelées valeurs pKa, qui indiquent le pH auquel des acides aminés spécifiques (les éléments constitutifs des protéines) gagnent ou perdent des protons. Ces informations permettent au programme de modéliser la façon dont les charges électriques au sein des protéines changent en fonction des niveaux de pH et de prédire comment ces changements de charge pourraient modifier la structure des protéines.
Les chercheurs ont concentré leur attention sur les acides aminés qui inversent facilement leur charge dans la plage étroite de pH typique des cellules saines (environ 7,2 à 7,6). Même des changements subtils dans ces charges cruciales d’acides aminés peuvent déclencher un effet domino, se répercutant sur l’ensemble de la structure protéique et ayant un impact sur sa fonction. Ce phénomène est connu sous le nom d’allostérie – un mécanisme de régulation indirect qui influence l’activité des protéines loin du site où se produisent les changements de pH.
Cibler le cancer grâce à la découverte informatique
Le pipeline a réussi à prédire la sensibilité au pH d’une protéine clé appelée SHP2, impliquée dans la signalisation cellulaire, la réponse immunitaire et le développement. Les expériences ont confirmé que la liaison des protons à deux résidus spécifiques au sein de SHP2 entraîne un changement radical de sa forme, le faisant passer d’un état « fermé » inactif à un état « ouvert » actif. Cette découverte met en lumière la manière dont le pH contrôle subtilement l’activité de SHP2.
En outre, le pipeline a identifié un modèle de sites sensibles au pH dans une large gamme de protéines contenant le domaine SH2, notamment c-Src. C-Src est souvent hyperactif dans de nombreux cancers, entraînant une croissance cellulaire incontrôlée. L’analyse a révélé que la c-Src normale se comporte différemment à différents niveaux de pH : elle est active à faible pH et inactive à pH élevé. Cependant, des mutations liées au cancer dans ces sites spécifiques sensibles au pH perturbent cette régulation délicate, rendant c-Src insensible aux changements de pH et contribuant à sa suractivité dans les tumeurs.
Cette découverte ouvre des perspectives passionnantes pour les thérapies ciblées contre le cancer. En comprenant précisément comment le pH régule l’activité de c-Src, les chercheurs peuvent désormais concevoir des médicaments qui imitent les mécanismes de régulation naturels, rétablissant une sensibilité normale au pH et inhibant sélectivement la forme mutée de la protéine, responsable de la maladie.
Cet outil informatique révolutionnaire promet de révolutionner notre compréhension de la fonction des protéines dans la santé et la maladie. Au-delà du cancer, le ciblage des protéines sensibles au pH présente un immense potentiel pour traiter un large éventail de pathologies dans lesquelles les déséquilibres du pH contribuent au dysfonctionnement – du diabète aux maladies auto-immunes en passant par les traumatismes crâniens. À mesure que les chercheurs exploitent ce nouveau pouvoir, l’avenir s’annonce plus prometteur pour le développement de thérapies hautement ciblées et efficaces.