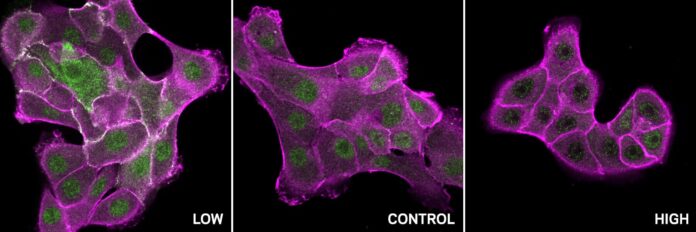
Piccoli cambiamenti nell’acidità all’interno delle nostre cellule possono avere enormi impatti sul loro comportamento. Questa influenza deriva da qualcosa chiamato concentrazione di protoni, o pH, una misura di quanto sia acida o alcalina una soluzione. Le proteine, i cavalli da lavoro delle nostre cellule, sono particolarmente sensibili a questi cambiamenti. Le alterazioni nella reattività del pH possono contribuire allo sviluppo di malattie come il cancro e disturbi neurodegenerativi come l’Alzheimer e l’Huntington.
Per anni, i ricercatori hanno lottato per individuare esattamente come le proteine rispondono ai cambiamenti dei livelli di pH. Tradizionalmente, identificare le proteine sensibili al pH comportava un processo noioso: testare meticolosamente ciascuna proteina individualmente all’interno di un percorso di segnalazione per vedere se reagiva ai cambiamenti di pH. Questo approccio scrupoloso ha prodotto risultati limitati. Sebbene gli scienziati sappiano che il pH svolge un ruolo in processi cellulari cruciali come il movimento e la divisione cellulare, tra innumerevoli possibilità è stato confermato che solo circa 70 proteine citoplasmatiche sono sensibili al pH.
Ora, i ricercatori dell’Università di Notre Dame hanno sviluppato uno strumento computazionale rivoluzionario che accelera notevolmente questo processo. Questa pipeline può analizzare centinaia di proteine in pochi giorni, prevedendo in modo efficiente quali sono sensibili ai cambiamenti di pH e potenzialmente guidando la progressione della malattia.
Svelare il codice molecolare della sensibilità al pH
Il nuovo metodo si basa sui dati strutturali esistenti delle proteine ospitati in un archivio globale chiamato RCSB Protein Data Bank. Il programma incorpora quindi dati sperimentali noti come valori pKa, che indicano il pH al quale specifici aminoacidi (gli elementi costitutivi delle proteine) acquistano o perdono protoni. Queste informazioni consentono al programma di modellare il modo in cui le cariche elettriche all’interno delle proteine cambiano a seconda dei livelli di pH e di prevedere come questi cambiamenti di carica potrebbero alterare la struttura delle proteine.
I ricercatori hanno concentrato la loro attenzione sugli amminoacidi che cambiano facilmente la loro carica all’interno del ristretto intervallo di pH tipico delle cellule sane (da circa 7,2 a 7,6). Anche i più piccoli cambiamenti in queste cariche cruciali di aminoacidi possono innescare un effetto domino, che si ripercuote sull’intera struttura proteica e incide sulla sua funzione. Questo fenomeno è noto come allosteria, un meccanismo di regolazione indiretto che influenza l’attività delle proteine lontano dal sito in cui si verificano i cambiamenti di pH.
Mirare al cancro attraverso la scoperta computazionale
Il progetto ha previsto con successo la sensibilità al pH di una proteina chiave chiamata SHP2 coinvolta nella segnalazione cellulare, nella risposta immunitaria e nello sviluppo. Gli esperimenti hanno confermato che il legame dei protoni a due residui specifici all’interno di SHP2 provoca un cambiamento drammatico della sua forma, passando da uno stato inattivo “chiuso” a uno stato attivo “aperto”. Questa scoperta fa luce su come il pH controlla sottilmente l’attività SHP2.
Inoltre, la pipeline ha identificato un modello di siti sensibili al pH in un’ampia gamma di proteine contenenti domini SH2, inclusa c-Src. C-Src è spesso iperattivo in molti tumori, determinando una crescita cellulare incontrollata. L’analisi ha rivelato che il normale c-Src si comporta diversamente a diversi livelli di pH: è attivo a pH basso e inattivo a pH elevato. Tuttavia, le mutazioni correlate al cancro in questi specifici siti sensibili al pH interrompono questa delicata regolazione, rendendo c-Src insensibile alle variazioni di pH e contribuendo alla sua iperattività nei tumori.
Questa scoperta apre strade entusiasmanti per terapie mirate contro il cancro. Comprendendo esattamente come il pH regola l’attività della c-Src, i ricercatori possono ora progettare farmaci che imitano i meccanismi naturali di regolazione, ripristinando la normale sensibilità al pH e inibendo selettivamente la forma mutata della proteina che causa la malattia.
Questo innovativo strumento computazionale promette di rivoluzionare la nostra comprensione della funzione delle proteine nella salute e nella malattia. Oltre al cancro, prendere di mira le proteine sensibili al pH ha un immenso potenziale per il trattamento di una vasta gamma di condizioni in cui gli squilibri del pH contribuiscono alla disfunzione, dal diabete e i disturbi autoimmuni alle lesioni cerebrali traumatiche. Man mano che i ricercatori sfruttano questo nuovo potere, il futuro appare più luminoso per lo sviluppo di terapie altamente mirate ed efficaci.